尽管当下的类器官作为可在体外复现生理结构和分子特性的3D平台,已经在多种疾病的建模中展现出了无可比拟的还原忠实度,但其仍旧存在缺乏免疫系统、细胞类型单一、血管化不足等严重问题。其中,由于静态培养的类器官模型缺少运输氧气和营养、清除废物、运输免疫细胞的血管网络,随着体外增殖进行,内部会逐渐出现中心区域坏死的现象。而在心脑血管疾病研究中,血脑屏障的整合对于药物评价和测试更是具有巨大意义。因此,类器官血管化已经成为下一代体外模型的重点研究方向。
除移植肾被膜催化的“体内血管化”外,更多的研究者正在探索体外血管化的方案。一些研究则利用生物材料和生物打印技术,但在血管的成熟度和稳定性方面仍存在不足。与具备血管网络自组装能力的血管内皮细胞共培养是另一个可行的方向,但获得的类器官具有不同水平的内皮细胞、平滑肌细胞和祖细胞,不利于模型稳定性。
2025年6月5日,斯坦福大学研究团队在顶刊Science发表重磅论文“Gastruloids enable modeling of the earliest stages of human cardiac and hepatic vascularization”,报道了一种能够模拟人类心脏和肝脏早期血管化过程的体外类器官模型。该团队从人多能干细胞(hPSCs)出发,通过微图案化及CHIR添加,首先诱导了中胚层的有序分化与心血管祖细胞的形成,随后添加血管化诱导因子VEGF/FGF2/SB/ANG1/2/PDGF-BB/TGF-β1等,成功构建了具有心肌细胞、内皮细胞和平滑肌细胞的心脏类器官(cVOs),并在多重表征鉴定中确定其具有近似人胎儿心脏的血管网络与心肌功能。该模型可用于体外心血管机制的深入探索,并具有普适性,可迁移并培养肝脏血管化类器官(hVOs),对于临床研究具有重要启示意义。

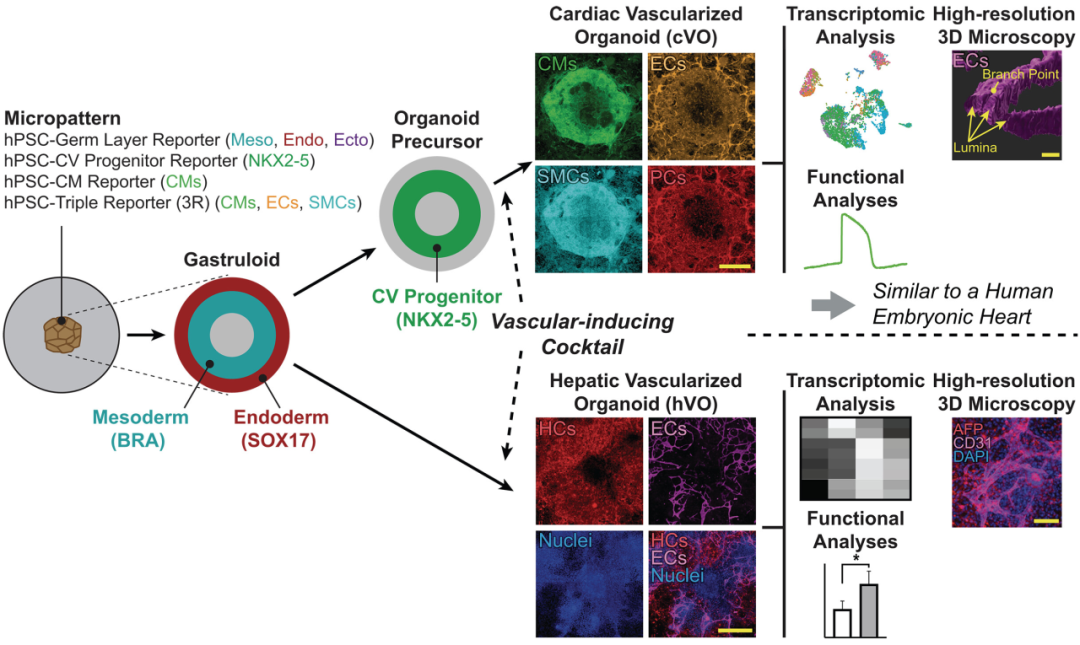
图:微模式化和生长因子的添加是实现了类原肠胚、心血管、祖细胞和cVO的体外形成
01 心脏血管化类器官的构建
微图案化技术与CHIR诱导中胚层有序分化
此前的研究已经表明,hPSC的几何微图案化(Micropatterning)通过在基底上创建特定的几何形状或化学模式,精确控制细胞的生长环境,从而以可重复和可扩展的方式形成在空间上具有明确排列和组织结构胚层(包括内胚层、中胚层和外胚层),并可进一步发育为心脏类器官等。此外,GSK3β抑制剂CHIR也已被证明可以增强Wnt信号传导、从而促进中胚层的形成与分化。
因此,本研究首先使用了模具对hPSC和人胚胎干细胞(hESC)进行微图案化、并加入了CHIR进行中胚层分化诱导,力图同时生成心肌细胞(CM,负责心脏的收缩和舒张)、内皮细胞(EC,血管内皮的主要成分)和平滑肌细胞(SMC,负责血管的收缩和舒张)三种构建功能性心脏类器官及心血管的关键细胞。
研究发现,未图案化的hESCs在不同浓度的CHIR诱导下形成的胚层细胞呈无序分布。而微图案化的hPSCs在CHIR诱导下能够一致地生成有序的中胚层,表现为围绕高度集中的中胚层形成了内胚层环,而外胚层在此缺失。这种有序的排列模式与体内胚胎发育过程中的胚层排列相似,表明微图案化技术能够模拟体内发育过程。
该结果表明,CHIR诱导和微图案化对于具备三种细胞类型的心脏类器官的形成缺一不可。
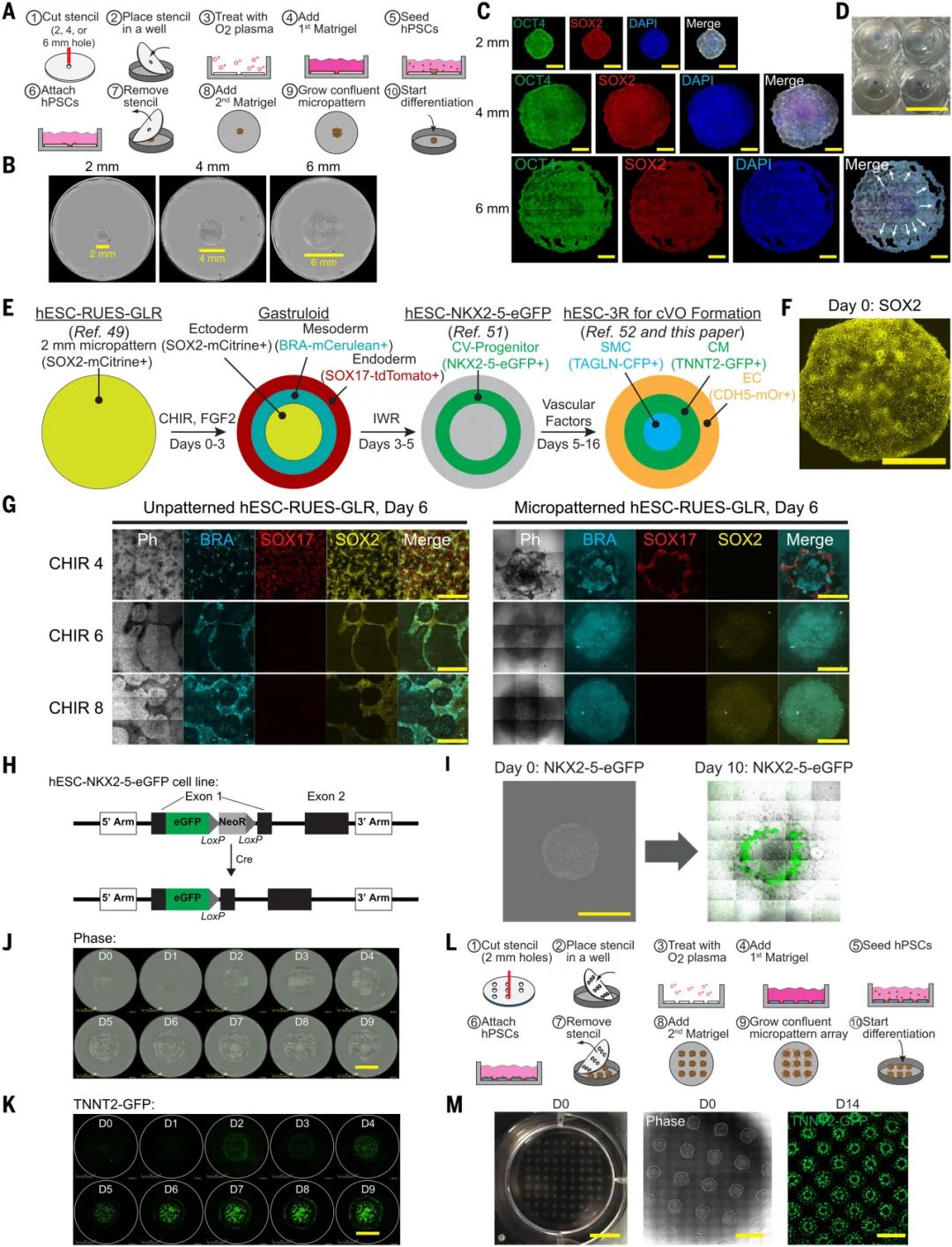
图:hPSC的微图案化及CHIR的添加诱导了有序中胚层的形成,为CM、EC、SMC的同步生成奠定基础
心血管祖细胞的形成
接下来,研究团队将心血管祖细胞标志物NKX2与绿色荧光蛋白eGFP融合,发现单个微图案化已经可以在10天的分化后产生心血管祖细胞,并进一步分化形成跳动的CM。
此外,三种荧光hPSC报告系统也证明,微模式化成功产生了有组织的胚层、心血管祖细胞和CM,从而为后续筛选能够促进心脏血管化类器官(cVOs)形成的条件提供了基础。
cVOs分化方案的确定
接下来,研究团队继续使用荧光报告系统,筛选确认了 CM、EC 和 SMC 共分化并最终形成 cVO 的培养方案。其中主要涉及到血管内皮生长因子(VEGF)的添加。
VEGF / novoprotein
血管内皮生长因子(VEGF)是促进血管通透性和血管发成的关键因子,在生理和病理环境中由多种细胞分泌。其已经在此前的研究中用于肾脏类器官、心脏类器官、肝脏类器官等体外血管化的诱导。
近岸蛋白提供经类器官培养验证的VEGF165,具有高活性,高批间一致性,确保实验可重复性。
经类器官培养验证基质胶、细胞因子&培养基
通过对34种不同培养条件的对比,研究者发现,添加细胞因子VEGF、FGF2、SB、ANG1/2、PDGF-BB、TGF-β1的组在血管化和功能化方面表现最优。
基于此,研究团队确认了四阶段的分化方案:
-
中胚层诱导(第0天):CHIR(5 μM) + FGF2(5 ng/mL)
-
心血管前体形成(第3天):IWR(5 μM)
-
血管生成启动(第5天起):VEGF(50 ng/mL)+FGF2++ SB431542(SB,TGFβ抑制剂)+血管生成素-1/2(ANG1/2)
-
血管成熟(第7天起):血小板衍生生长因子 BB (PDGF-BB,10 ng/ml) +转化生长因子-β1 (TGF-β1)
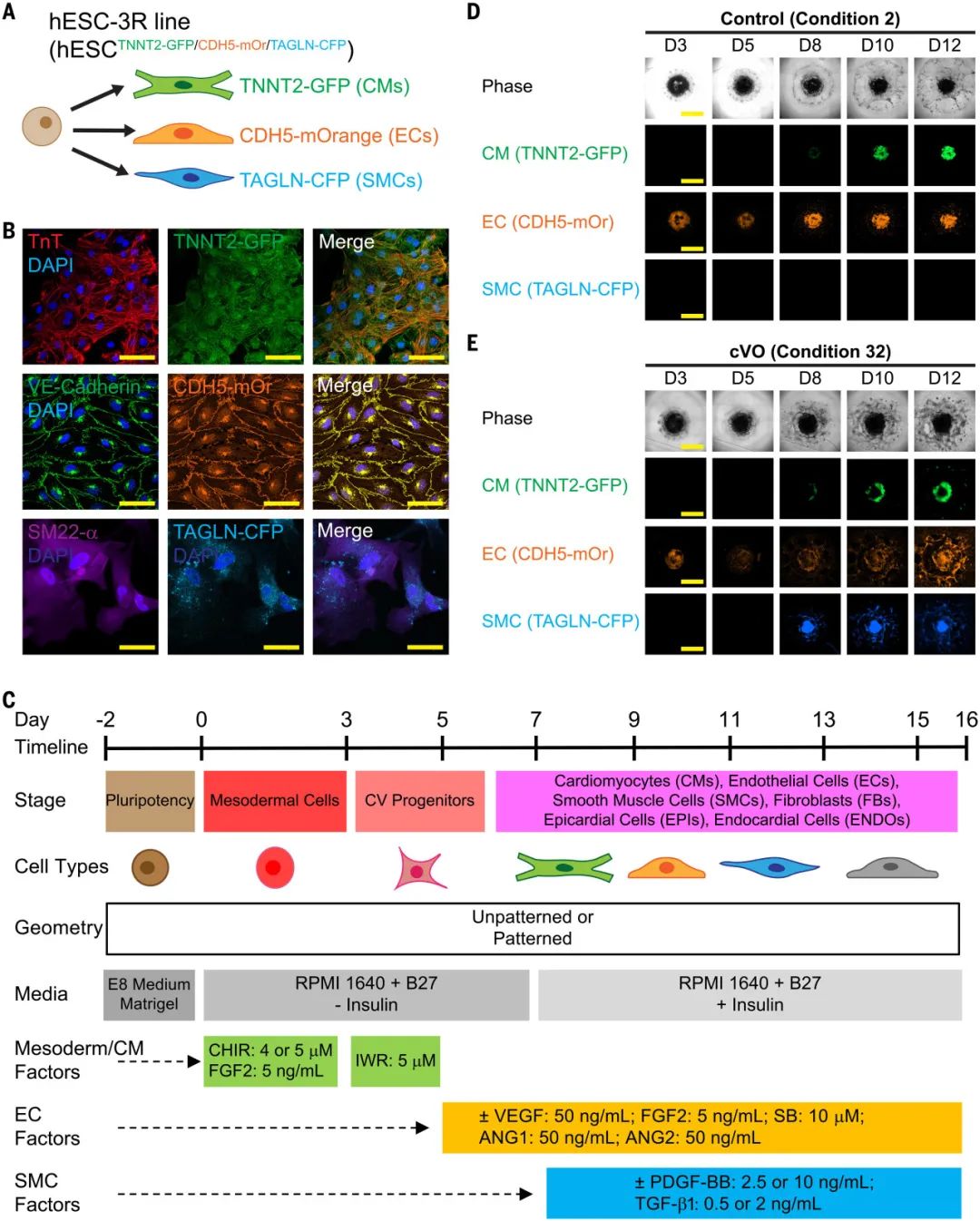
图:cVO的分化方案
cVOs分化方案的优化
研究团队接下来提升了CHIR的浓度,发现7.0 μM的CHIR可诱导hESC产生最多的CM和EC。该血管化方案在hiPSC中同样诱导了稳健的血管化,因此被确认为最终的使用方案。
cVO类胚胎特征的检验与表征
在结构层面,cVOs发育至第16天(相当于人体内发育3周)呈现有序的同心圆结构,表现为CMs形成外层收缩环,SMCs位于中心,分支状ECs网络贯穿其中并随着CM收缩而同步移动,类似于人体内心脏和血管系统中ECs的分布与功能。免疫染色通过标志物证实了三种细胞中各自的身份。
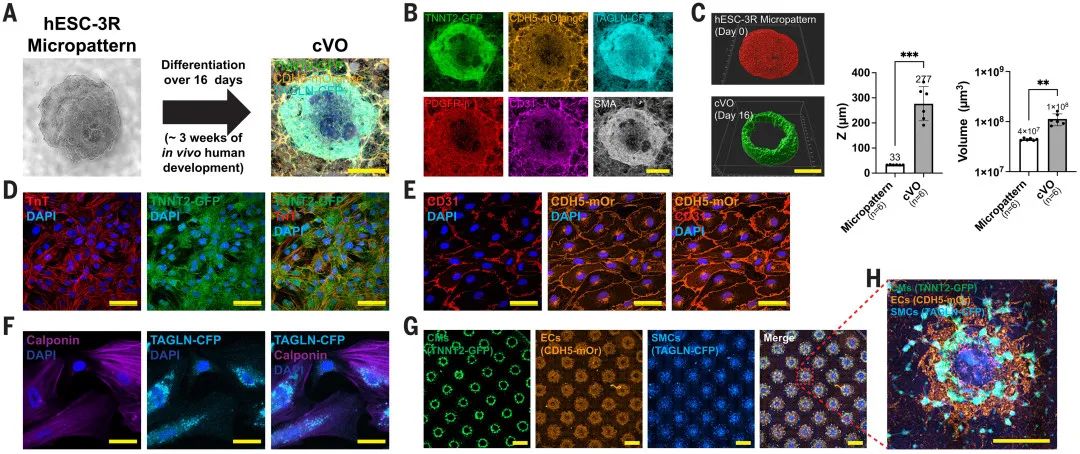
图:cVOs的结构
在转录组层面,时序性bulk RNA-seq与WGCNA分析揭示,血管生成基因簇(如PECAM1、HIF1A、NOTCH4)在cVOs中特异性上调,峰值见于第16天。此外,大量与心脏发生和血管化相关以及一些已知在心血管发育中起重要作用的经典通路均有上调。尤其NOTCH通路关键基因(JAG1/2、DLL4、NOTCH1-4)从第5天(添加血管因子时)开始与对照组显示出显著的差异化表达。
对第16天的cVOs进行scRNA-seq,并与6.5孕周(PCW)人胚胎心脏(Carnegie Stages 19-20)联合分析,发现cVOs包含15-17种心脏细胞类型,与6.5 PCW心脏(16种)高度重叠。但同时二者间也存在一定的差异,如cVOs中造血细胞比例较低,而成纤维细胞和心外膜细胞占比更高。此外,值得注意的是,cVO也未能囊括6.5-PCW 心脏或 Azimuth 成人心脏参考模型中发现的所有细胞类型。
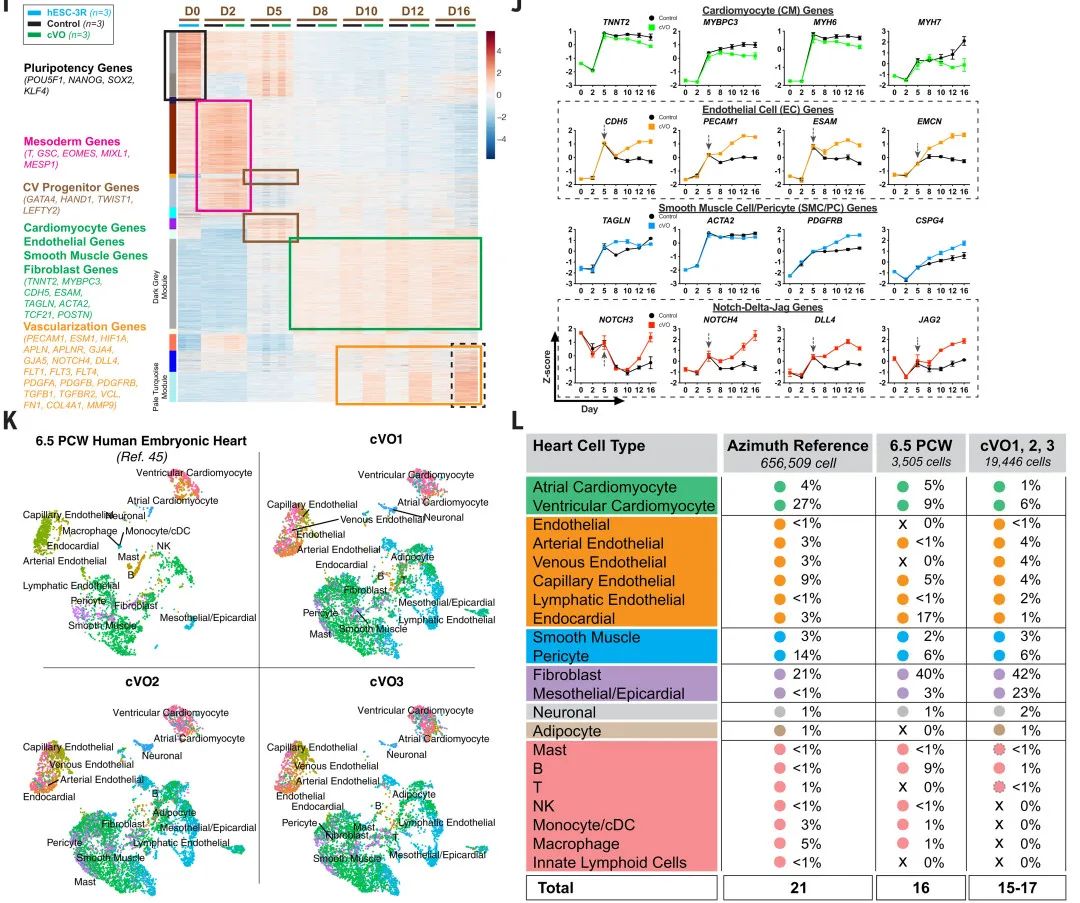
图:cVO 包含多种心肌、血管、心内膜、心外膜和神经元细胞类型
在功能分析方面,最大强度投影 (MIP) 共聚焦成像和3D表面渲染证实了管腔化血管网络的形成。电生理学实验则发现,cVOs的节律性收缩与人类胚胎心脏相似。此外,钙瞬变分析也证实,cVOs在功能上表现出比对照组更强的收缩力和更稳定的搏动节律,但同时也伴随着更长的收缩舒张期,可能需要进一步的优化。
总之,以上结果表明,cVOs是一个具有功能性血管网络的类器官模型。
02 利用cVOs探索血管化机制
血管化信号通路
NOTCH和BMP通路对心血管发育、疾病和再生至关重要。本文中,研究者利用已获得的cVOs模型,发现添加任何剂量的NOTCH通路抑制剂DAPT均可以以非剂量依赖性方式抑制CM及EC生成,且对CMs的负面影响强于ECs。而Dorsomorphin对ECs的负面影响强于CMs,后者仅受到高剂量BMP抑制剂Dorsomorphin的抑制。
以上结果表明,BMP通路对血管形成的调控权重高于NOTCH通路,且双通路抑制均破坏心-血管协同发育。
03 肝脏血管化类器官的构建
除cVOs外,研究团队还利用相同的血管诱导因子组合(VEGF/FGF2/SB/ANG1/2/PDGF-BB/TGF-β1),成功构建了肝脏血管化类器官(hVOs),从而进一步验证了该血管化策略的普适性。不同于发育自均中胚层的ECs、SMCs以及心血管祖细胞,肝脏中肝细胞和胆管细胞来自于内胚层,因此研究人员对培养方案进行了微调,将同步诱导内胚层与中胚层有序分化。
实验结果显示,hVOs在结构上具有明显的层次结构,包含了肝脏细胞、内皮细胞、平滑肌细胞等多种细胞类型,具有功能性血管网络。该结果表明,在不同器官系统中,血管的构建涉及一个保守的发育程序,提示该方案或可作为起点,在未来实现其他器官系统的血管化。
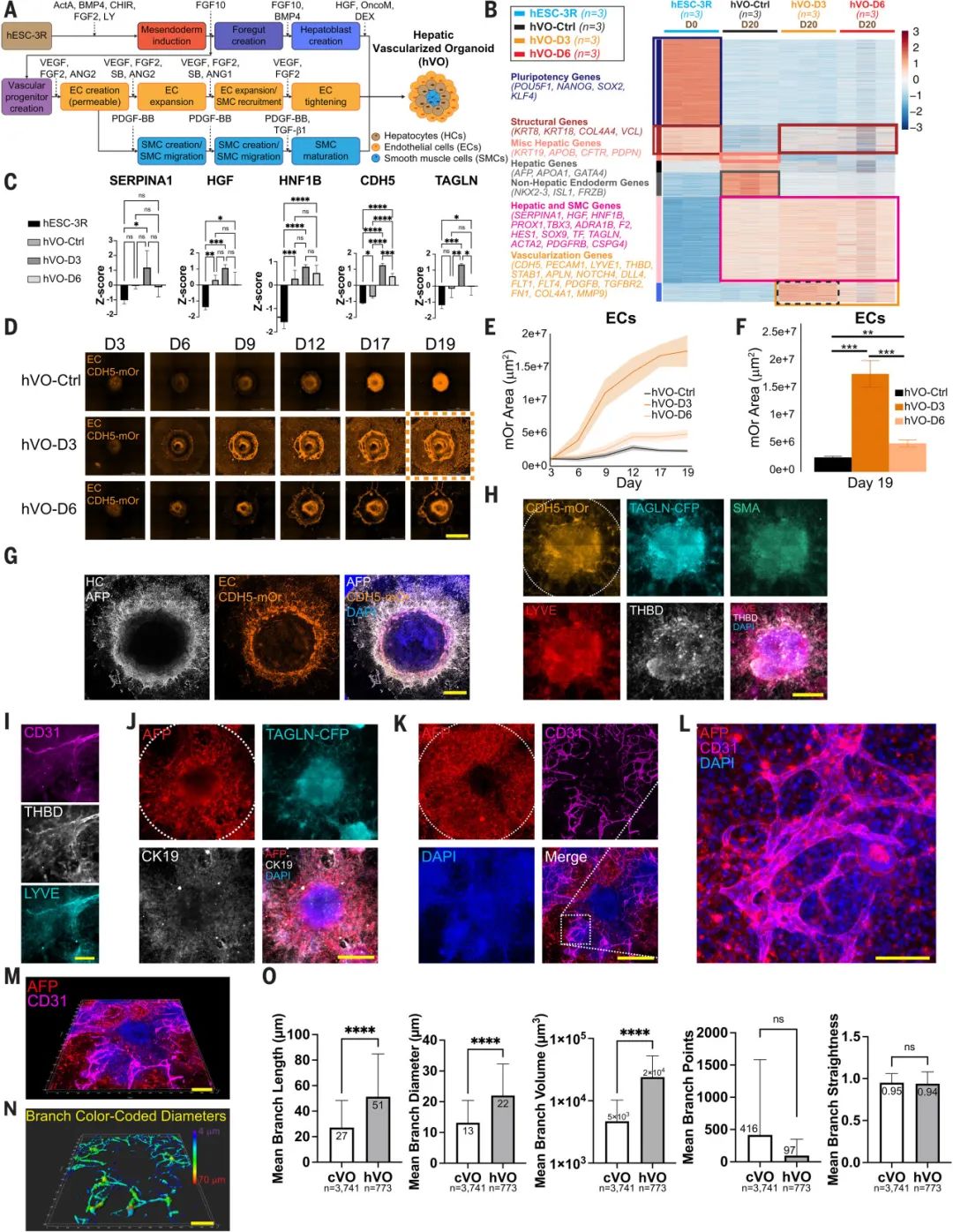
图:cVOs分化方案成功诱导肝脏类器官血管化
04 未来展望
本文中,斯坦福大学的研究团队开发出一种围绕“微图案化技术、CHIR及血管生长因子”的血管化方案,成功培养了心脏和肝脏血管化类器官,并模拟了人类早期器官发育过程中的血管化现象,这不仅为类器官技术的发展提供了新的思路和方向,更为再生医学领域带来了新的希望。
近岸蛋白相关产品
近岸蛋白提供多种类器官体外培养全方案,包括基质胶、培养基、相关细胞因子等:
经类器官培养验证的完全培养基
经类器官培养验证的细胞因子
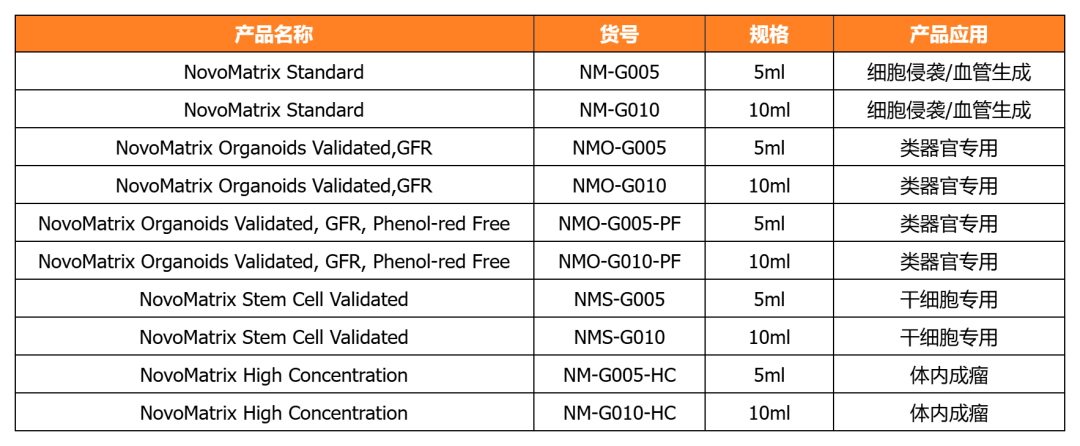
NovoMatrix 基质胶
参考资料
Abilez OJ, Yang H, Guan Y, et al. Gastruloids enable modeling of the earliest stages of human cardiac and hepatic vascularization. Science. 2025;388(6751):eadu9375. doi:10.1126/science.adu9375
