
期刊:Nature Communications
影响因子:14.7
主要技术:scRNA-seq、Xenium
导语
研究人类胎儿肺可以了解发育缺陷和疾病状态如何改变肺的功能。在这里,我们对19个健康人假腺体胎儿肺组织的>150000个单细胞进行了测序,时间范围在妊娠10-19周之间。我们从表达丰富水平的囊性纤维化电导跨膜调节因子 (CFTR)的祖细胞中捕获动态发育轨迹。这些细胞产生多种特化的上皮细胞类型。结合空间转录组学,我们展示了关键信号通路的时间调控,这些通路可能驱动特化上皮细胞(包括纤毛细胞和肺神经内分泌细胞)的时间和空间出现。最后,我们表明人类多能干细胞衍生的胎肺模型包含表达 CFTR 的祖细胞,这些祖细胞捕获与天然组织中鉴定的相似的谱系发育轨迹。总体而言,本研究提供了发育中人肺的全面单细胞图谱,概述了细胞谱系发育的时间和空间复杂性,并对从人多能干细胞分化到类似发育窗口的胎儿肺培养进行了基准测试。
主要技术
scRNA-seq、Xenium
研究结果
1.人胚胎肺的细胞组成
收集总共19个来自选择性终止妊娠的新鲜分离的胎儿肺组织,范围从孕周(GW)10-19,并进行处理,用于3 '单细胞RNA测序(scRNA-seq)。从肺部的不同区域对一个组织进行两次采样,以确保均匀捕获。总共对170256个单细胞进行了测序,每个细胞的读取深度约为60000。生成FASTQ文件,并将读数与人类参考基因组hg 38(GRCh 38)进行比对。去除低质量细胞、死细胞和双细胞后,分析了156,698个细胞。经过标准化和降维后,使用倒数主成分分析(rPCA)来识别锚点,以进行整合以生成胎儿肺数据集。根据男性性别决定基因SRY和DDX 3 Y以及XIST的表达,收集了12个男性和7个女性的肺部(图1A)。使用基于非参数Wilcoxon等级和检验的差异表达基因(DEG)来注释细胞群,将细胞群广泛分为5个独特不同的细胞群(图1B)指定为矩阵(N = 98166; Col 1A 1、Col 1A 2),表皮(N = 16068; EPCAM)、内皮细胞(N = 13376; PECAM 1)、免疫细胞(N = 16258; CD 74、CD 3、NKG 7)和施旺细胞(N = 512; NRXN 1、S100 B、PLP 1)(图1C)。Clustree和DEG对每个主要细胞群进行了进一步的亚聚集,这导致发育中的肺部中总共有58种不同的细胞类型/状态(图1D)。评估整个妊娠时间的细胞比例显示,在整个10周的发育过程中,间质细胞构成了最大的细胞比例(图1 E)。
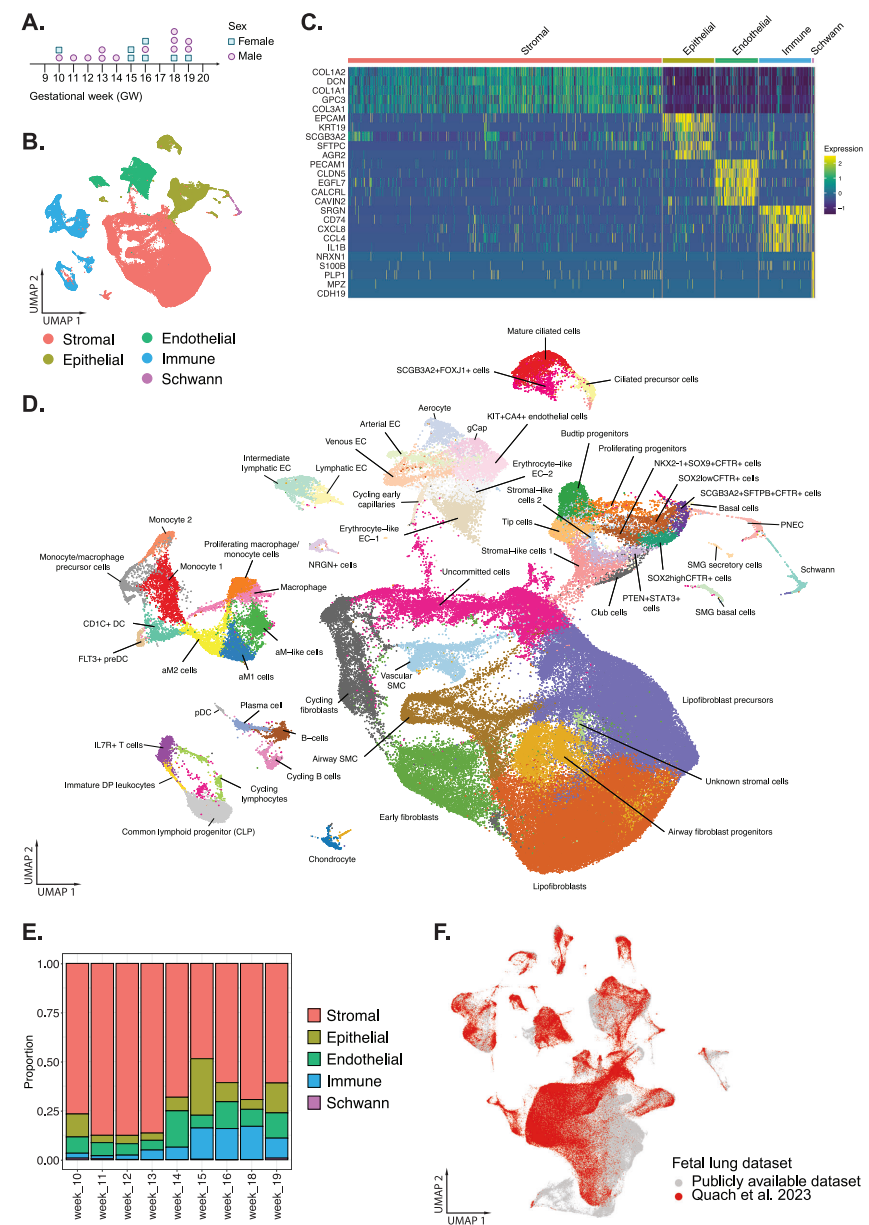
图1
2. 发育中的肺间质
在分析的所有肺组织中,间质细胞构成了最大比例的细胞(图1B)。我们根据DEG确定了10种间质细胞亚型(图2A)。这些包括脂成纤维细胞、脂成纤维细胞前体、循环成纤维细胞、早期成纤维细胞、气道成纤维细胞祖细胞、未定型细胞、气道平滑肌细胞、血管平滑肌细胞、软骨细胞和未知的间质细胞群。脂成纤维细胞和脂成纤维细胞前体是整个妊娠周中含量最丰富的间质细胞类型(图2B)。这两种细胞类型都表达TCF 21,这是一种先前在小鼠胎儿和成人肺成脂纤维细胞中显示的标志物。脂肪成纤维细胞前体差异表达更高水平的几种典型间充质相关基因,包括PLEKHH 2和MACF 1(图2C),类似于小鼠脂肪成纤维细胞细胞系。在脂肪成纤维细胞中鉴定的最高差异转录因子JUN、FOS和STAT 3的调节子活性(图2D),已知其调节结构性细胞外基质(如胶原蛋白和弹性蛋白)的合成,并且在肺泡发育中很重要。虽然肺泡发育发生在妊娠后期,但早期胎儿肺发育中的脂成纤维细胞在形成气道结构所需的ECM蛋白中发挥作用。驱动脂肪成纤维细胞前体的转录因子的差异调节子活性包括NR2F1和ETV 1,其调节细胞生长、繁殖和分化(图2D)。气道成纤维细胞表达高水平的TWIST 1、NIX和ZEB 1(图2D)。
接下来,我们使用Xenium高分辨率多路原位空间分析来确定每个间质细胞亚型中表达的DEG的空间定位。我们在胎儿肺组织的间质区域中鉴定了与气道成纤维细胞祖细胞(WRPINF 1、FBN 1、IGMBE 5)、脂成纤维细胞前体(MACF 1和TCF 21)和脂成纤维细胞(ERG 1、ATF 3、IRF 1)相关的基因(图2 E)。气道成纤维细胞祖细胞主要集中在大气道(表皮1)周围,而脂成纤维细胞前体则出现在整个间质中。此外,还观察到分散在表皮周围的脂成纤维细胞前体之间的脂成纤维细胞。
周期性成纤维细胞和早期成纤维细胞在早期肺组织中也以相对较高的比例存在(GW 10-14;分别为~ 6-10%和~ 9-12%),但在晚期妊娠肺组织中逐渐减少(GW 15;分别为~2-5%和~3-7%)(图2B)。除了常见的胶原基因(Col 1A 1、Col 1A 2)外,周期成纤维细胞表达了高水平的与细胞增生相关的基因TOP 2A、CENPF、MKI 67(图2C)。早期成纤维细胞表达了高水平的与染色质重塑相关的基因,例如HELS和TYMS 29(图2D),此前已证明这些基因在小鼠胚胎成纤维细胞中高度表达。早期成纤维细胞中具有差异性高调节子活性的转录因子包括E2 F7、E2 F8、FOXM 1、TCF 7和E2 F1。
根据UMAP预测,还有很大一部分未定型细胞与周期成纤维细胞和脂肪成纤维细胞前体密切相关(图2A)。这些未定向的细胞与循环成纤维细胞和脂肪成纤维细胞前体有一些转录相似性,但也表达与其他细胞类型相关的基因(图2C)。气道SMC差异表达更高水平的TAGLN、DES和MYH 11,而血管SMC表达IGFBP7、MEF 2C和EGFL 6,这两种情况在其他研究中也有类似的报道。TBX 5、MYEF 2和KLF 9的转录因子和相关调节因子在气道SMC中具有差异活性,而ZFN 41、PITX 3和HMGA 1在血管SMC中存在。软骨细胞差异表达许多胶原蛋白基因,包括Col 2A1、Col 11 A1、Col 9A1和RUNX 1,以及已知调节软骨细胞发育的FOXO 1相关调节子。具有明显DEG的未知一小群间质细胞(第10群)表达了高水平的AHSP、ALAS和BPGN,这些基因与红细胞相关。
为了推断成纤维细胞团的发育谱系,我们使用LatentVelo来估计不含气道SMC、血管SMC和软骨细胞的一组间质细胞上的RNA速度。为这个子集生成了新的UMAP,我们在UMAP嵌入和PAGA上可视化了这些速度(图3A、B)。推断轨迹表明,周期性成纤维细胞形成早期成纤维细胞,然后形成气道成纤维细胞祖细胞和脂成纤维细胞。我们使用Slingshot进一步验证了这些轨迹,使用循环成纤维细胞作为根细胞或细胞起源,并发现随着细胞沿着分化轨迹移动为脂成纤维细胞或气道成纤维细胞祖细胞,基因表达发生了逐渐变化(图3C、D)。
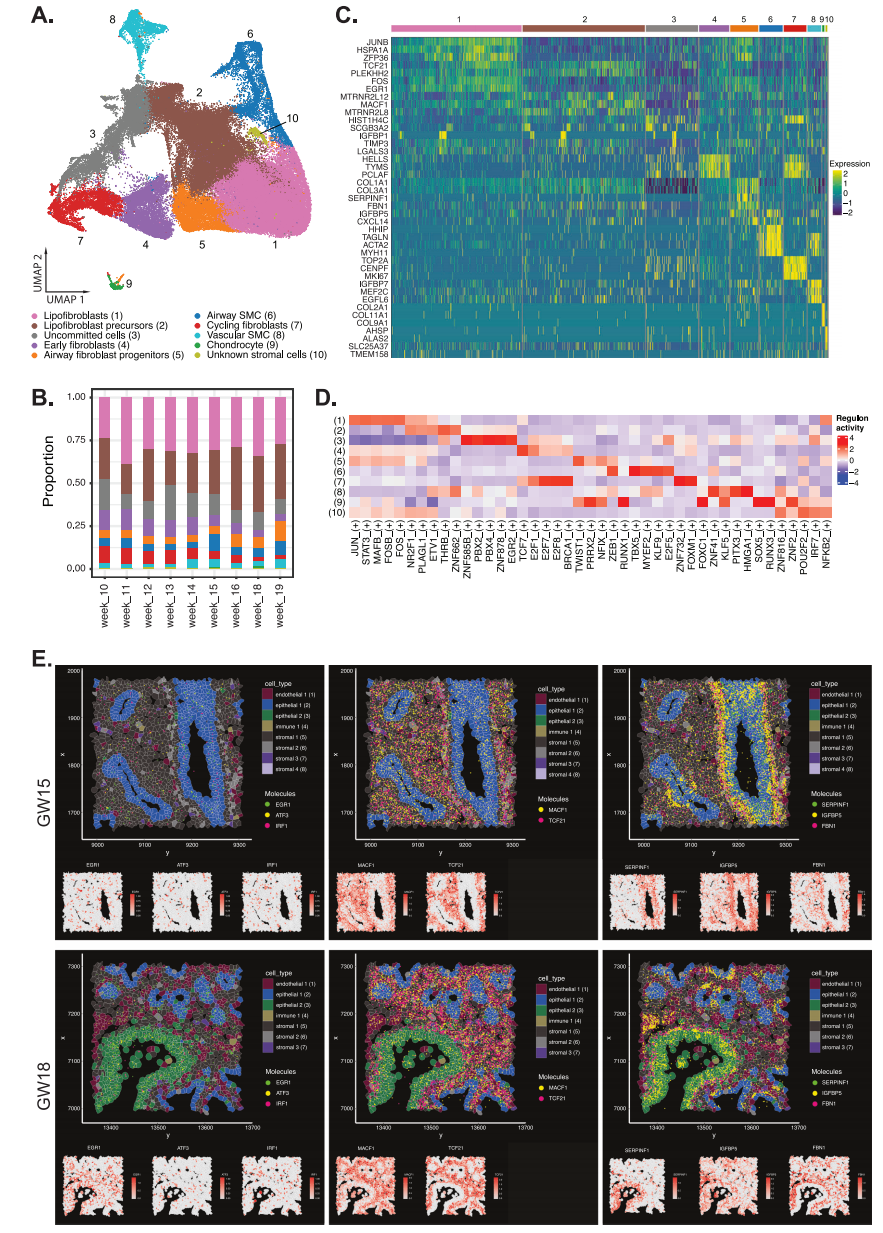
图2

图3
3. 动态演变的胎儿肺细胞
在胎儿肺表皮中,对topDEG的分析加上与特定细胞相关的典型表皮基因的高表达,揭示了19种亚型(图4A、B)。利用SOX 2和SOX 9的表达分别确定近端和远端气道细胞,我们鉴定了表达高水平SOX 2的表皮细胞亚群,这是一种共表达SCGB 3A2和SFTPB的CFTR表达细胞类型(SCGB 3A2 + SFTPB + CFTR +)、SCGB 3A 2 + FOXJ 1+和SOX 2 highCFTR+祖细胞群(图4C)。通过与细胞增生相关的基因MKI 67和编码微小管结合蛋白CENPF、NUSAP 1和CDK 1的细胞周期基因的表达升高来鉴定新生祖细胞(图4 B)。 空间Xenium分析显示NKX 2 -1 + SOX 9 + CFTR +仅限于表皮(表皮2,蓝色阴影),所有三个基因在GW 15和18肺组织的分叉区域或发育芽区均丰富表达(图4D)。相比之下,在气道的茎部区域发现了MEK 2 + CFTR +细胞。已知SOX 2表达可以调节表皮细胞的细胞增生,因此,SOX 2 highCFTR+细胞可能参与细胞扩张以形成发育中的气道。
使用免疫荧光染色,我们证实了NKX 2 -1、SOX 9和CFTR三阳性细胞在发育中的肺芽区域中的空间表达(图4 E)。相反,在胎儿气道中发现NKX 2 -1 + SOX 2 + CFTR +细胞,具有明显的SOX 2高(橙色箭头)和SOX 2低(白色箭头)细胞群。SCGB 3A 2 + SFTPB + CFTR +细胞在本文中被称为三重阳性(TP),差异表达更高水平的CXCL17、CP和CYB 5A(图4 B)以及转录因子HER 1(主要的NOTCH靶基因)和ASCL 2的差异高调节子活性,ASCL 2之前被证明是肠道表皮中的WNT/CTNNB 1转录靶点。发现这些TP细胞大量散布在整个气道中(图4D、E)。
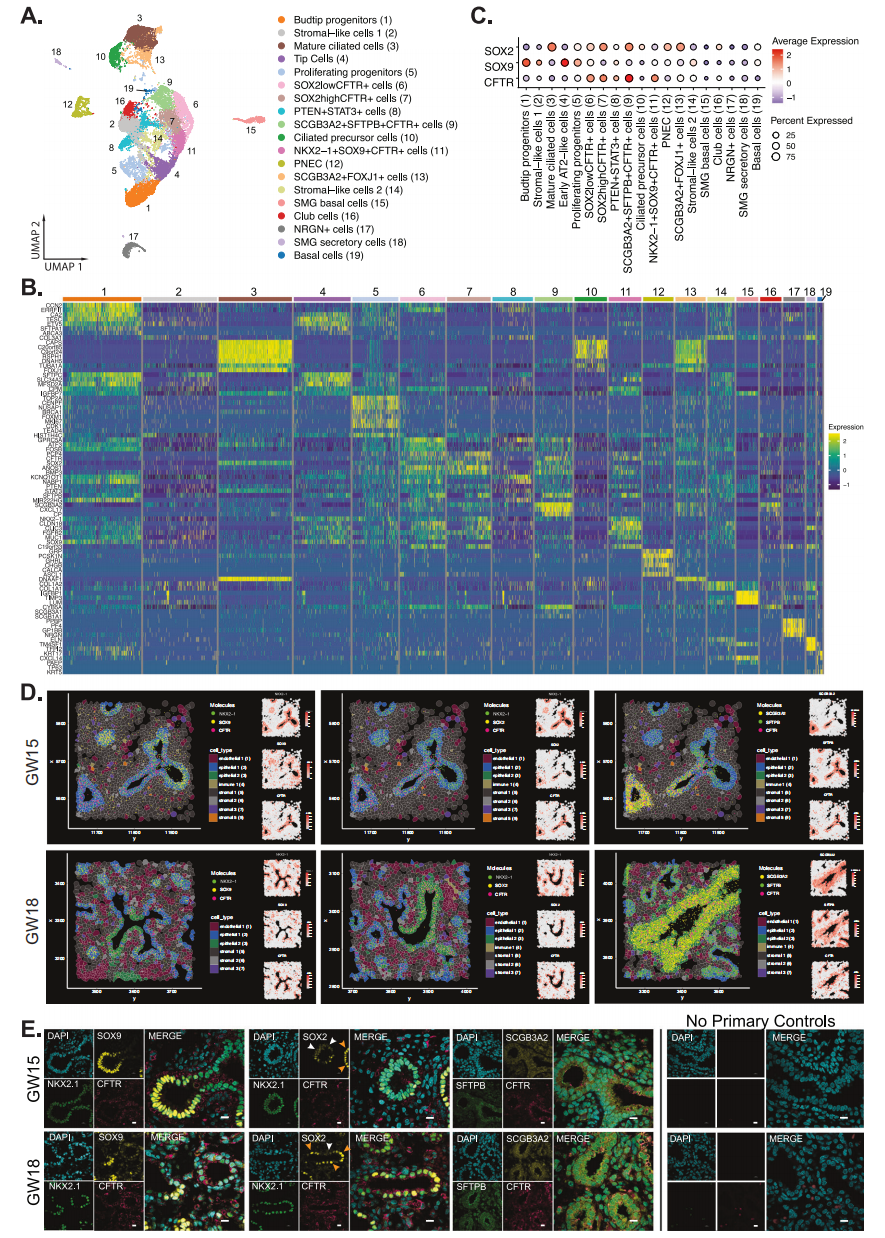
图4
4. 推测的表皮亚型轨迹
使用LatentVelo估计了RNA速率,以预测表皮细胞类型的谱系关系(图5A)。然后,我们使用CellRank 分析了LatentVelo速度,并确定了三种终末状态:成熟的纤毛细胞、PNEC和芽尖祖细胞(图5B)。基于使用LatentVelo的PAGA,我们观察到表明细胞高度可塑性和细胞谱系关系变化的轨迹(图5C)。假设表皮谱系的发育可能受到时间调节。基于几种典型细胞类型的出现,例如成熟的纤毛细胞和GW 14时PNEC细胞的显着下降(图5D)。在早期妊娠组织中,PNEC的贡献有多种来源,包括从芽尖祖细胞到尖端细胞到SOX 2 highCFTR到TP,然后是PNEC的轨迹。DEG的变化反映了细胞命运逐渐改变为PNEC分化(ASCL 1和GHRL的表达)(图5F)。沿着轨迹的细胞的富集反映了表型的变化。在从TP细胞向PNEC转化的过程中,参与FGF、NOTCH和TGFβ信号通路的基因上调。所有的PNEC轨迹在后期减弱,并且在这些后期阶段的PNEC细胞的比例降低(图5D)。几条轨迹聚集在妊娠中期组织中的TP上(图5E)。这些包括来自SOX 2lowCFTR+细胞、SOX 2 highCFTR+细胞、间质样细胞、增生祖细胞和基础细胞的细胞来源。在所有时间点都观察到NKX 2 -1 + SOX 9 + CFTR +和SOX 2lowCFTR+细胞之间的强联系(粗箭头线),以及后两种细胞具有TP,表明这些细胞与发育相关。我们推断的轨迹预测(图5F、G)和Xenium空间定位表明了SOX 9+细胞之间的关系。

图5
5. PNEC和纤毛细胞谱系中TP细胞的可塑性
离体谱系追踪研究表明,TP细胞可以在功能上对PNEC和下呼吸道中的纤毛细胞做出贡献。在我们的数据集中,我们发现这些细胞后期组织中PNEC下降,GW 14周围的纤毛细胞随之增加(图6A)。CellRank用于估计TP细胞的PNEC和成熟纤毛细胞命运概率,显示随着GW的增加,PNEC概率下降,成熟纤毛细胞概率增加(图6B)。PNEC标志物ASCL 1(黄色)和纤毛虫细胞标志物FOXJ 1(品红色)的免疫荧光染色显示早期GW组织中富含PNEC细胞,而这些细胞在GW 18胎肺中丢失(图6C)。空间转录组学的共现分析显示,这两种细胞类型都靠近TP细胞和SOX 2+细胞,表明这些细胞位于发育中的茎区,并对气道的谱系组成做出贡献(图4A、B)。总而言之,这些结果证明了PNEC和通过TP细胞的纤毛细胞分化的时间调节,支持这些祖细胞在发育中的肺中的动态可塑性。
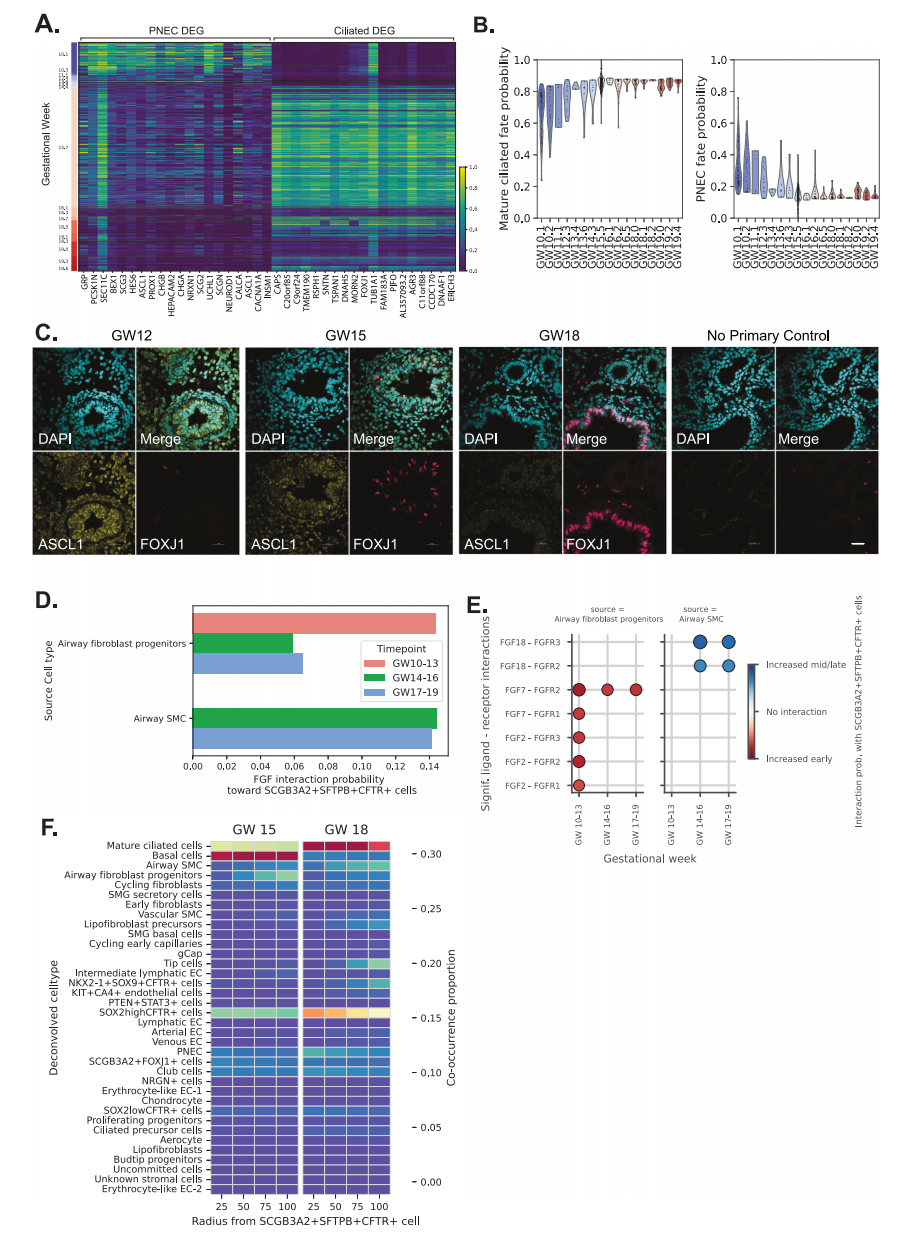
图6
6. FGF信号传递至TP的时间变化
相对于其他表皮细胞特异性靶向TP细胞的信号途径包括成纤维细胞生长因子(FGF,图6D)。FGF信号途径是一种参与肺分支形态发生的已知途径。此外,在定向分化方案中使用了几种FGF重组蛋白,以从人iPSC 16、18产生胎儿肺表皮细胞。因此,我们推测该途径可能在调节TP细胞命运方面发挥着重要作用。我们特别关注通过FGF信号与TP细胞的细胞间相互作用(图6 D)。根据Xenium的信息,我们鉴定了在空间上与TP细胞“紧密接近”的细胞,其中包括GW 15肺中的气道成纤维细胞祖细胞、SOX 2 highCFTR+细胞、PNEC、Club细胞和基础细胞,以及脂成纤维细胞前体、SCGB 3A 2 + FOXJ 1+、气道SMC和GW 18肺中的成熟纤毛细胞(图6 E)。然后,我们估计了参与TP细胞和FGF信号之间的特定配体-受体(L-R)相互作用。我们专门研究了气道成纤维细胞祖细胞和气道SMC,因为它们与基于共存细胞类型的TP细胞非常接近(图6E)。我们发现,妊娠早期(GW 10 -13)期间,涉及气道成纤维细胞祖细胞中表达的配体FGF 2和FGF 7的L-R相互作用之间的信号传递显着增加,并且我们发现,涉及气道SMC中表达的配体FGF 18的L-R相互作用的信号传递显着增加(GW 14 -16)或晚期(GW 17 -19)(图6F)。
7. hPSC衍生的胎儿肺分化捕获细胞异质性和在原生组织中发现的轨迹
hPSC的定向分化方案旨在捕捉发育里程碑,确保在细胞培养中真实细胞类型的稳健发展。随着分化变得更加先进,有能力产生hPSC衍生的组织特异性类器官,这些模型代表了研究发展基本机制。当获得用于研究的主要胎儿组织受到限制时,这一点尤其重要。在这里,我们试图使用我们最新的肺分化方案来确定我们认为是“胎儿”肺细胞和由hPSC产生的类器官的细胞的发育阶段(图7A)。我们对hPSC衍生的胎儿肺细胞进行了sc-RNA测序,认为其包含大部分未分化的肺上皮细胞和胎儿类器官,这些细胞将沿着分化途径进行下一步。
在聚类并进行DEG分析后,我们将这些hPSC细胞簇的DEG与原代胎儿肺样本中的DEG进行了比较。在hPSC胎儿肺细胞中,我们发现簇0和1中的增殖祖细胞和芽尖祖细胞有明显的重叠(图7B,C)。在这些胎儿肺细胞培养中出现的其他细胞类型的DEG包括PNEC、SOX2+、SOX9+祖细胞和第2簇的TP细胞。相反,hPSC衍生的胎儿肺类器官,代表了下一阶段的分化,包含与基底细胞、club细胞、PNEC、SMG分泌细胞、纤毛细胞和TP细胞显著重叠的细胞(图7D,E)。集群0和集群2中基底细胞的高度重叠并不令人惊讶,因为我们的类器官扩增培养基含有双重TGFβ/SMAD信号抑制剂:DMH1和A83-01,它们旨在促进基底细胞扩增。
为了将这些hPSC分化细胞与胎儿肺发育的妊娠时间点进行比较,我们使用了Spearman相关系数,发现hPSC分化细胞与这些早期胎儿肺组织的相关性相对较强。我们发现hPSC衍生的胎儿肺细胞与<GW12肺上皮组织相关性最强,hPSC衍生的胎儿肺类器官与>GW16肺上皮组织相关性最强(图7F)。重要的是,没有一种hPSC胎儿肺模型与成人肺有很强的相关性。
使用邻域分析,我们整合了hPSC来源的细胞和原代胎儿肺上皮(图8A)。综合UMAP显示,hPSC衍生的胎儿肺细胞(紫色)和类器官(绿色)与原代胎儿肺组织中的上皮细胞有明显的重叠(图8B)。为了了解这些hPSC分化在多大程度上代表了胎儿肺上皮的发育,我们将这些细胞定位在我们之前从天然组织推断的轨迹上。我们考虑了先前推断的胚胎初代上皮从芽尖祖细胞到TP细胞,通过尖端细胞,NKX2-1 + SOX9 + CFTR +细胞和sox2高/低CFTR +细胞的轨迹(图8C)。我们使用集成的最近邻图对集成的细胞进行聚类,并且只评估沿轨迹至少有100个细胞的聚类。因此,分析中没有显示胎儿和hPSC来源的培养物之间细胞重叠<100个细胞的集群(图8D)。
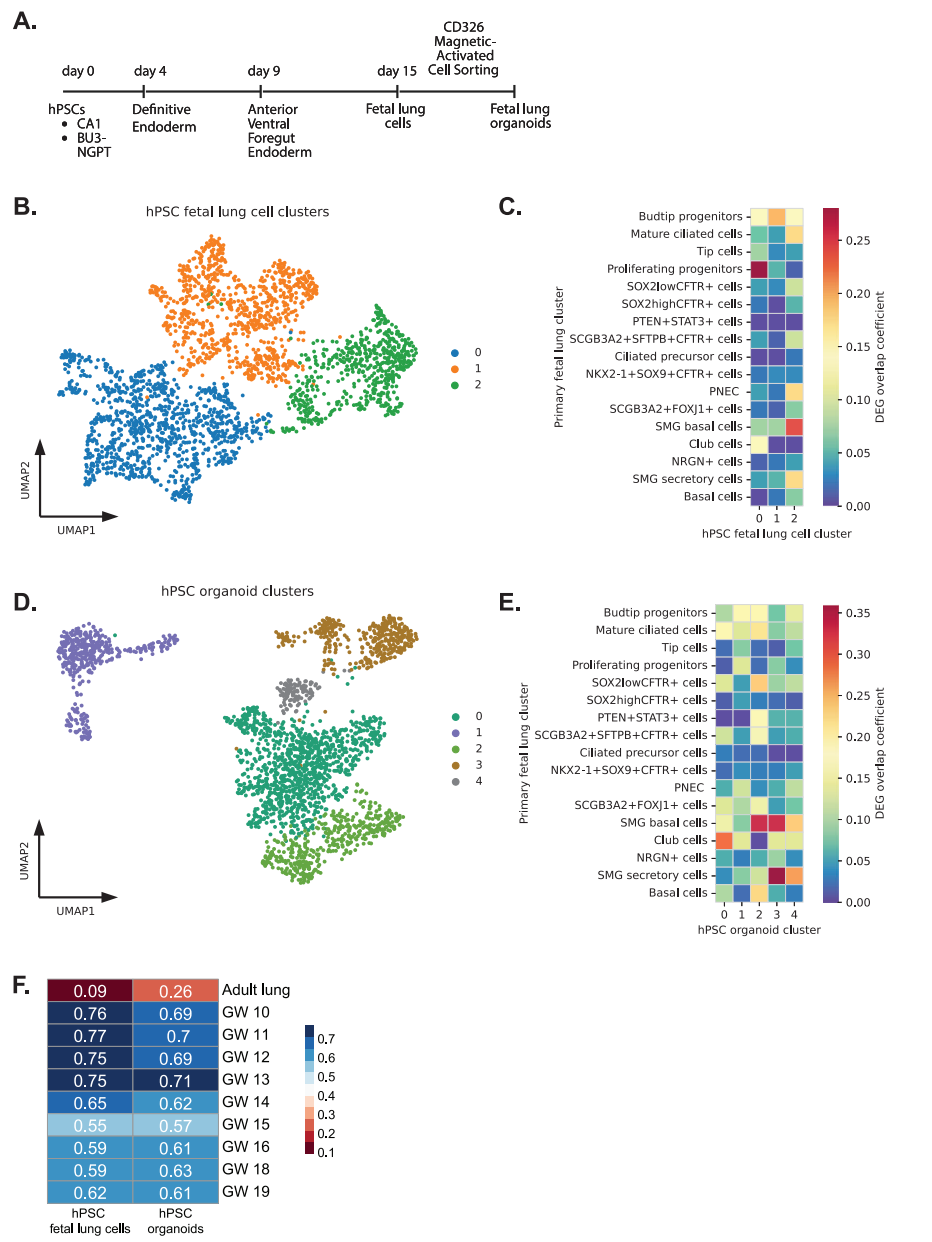
图7

图8
为了不偏不倚地确定hPSC衍生培养物中沿轨迹的上皮细胞亚型,我们从原代上皮组织中鉴定的每个簇的top100DEG中创建细胞类型评分,并使用每个包含hPSC胎儿肺细胞和类器官细胞的这些簇的平均拟时序,我们沿着轨迹定位簇(图8E,上面的箭头指向轨迹方向)。这些分数表明,随着获得与各种分化上皮细胞类型/状态(如基底细胞和TP细胞)相关的特定基因,胎儿肺类器官沿着这条轨迹逐渐分化。在hPSC胎儿肺细胞簇中,增殖祖细胞类型评分随着拟时序的增加而增加,而早期hPSC类器官簇随着增加而消失,而类器官中sox2高/低cftr +、TP和基底细胞类型评分则增加。基因表达变化的清晰模式沿着平均拟时序出现,在hPSC胎儿肺细胞中可以看到增殖祖标记基因的缺失(如TOP2A和CENPF),而获得了鉴定分化程度更高的细胞类型的基因,如sox2高/低cftr +细胞的GPC5A, TP细胞的CP和基底细胞的SPRR3(图8F)。
为了进一步证实整合细胞的分析,我们使用LatentVelo对hPSC胎儿肺细胞和hPSC类器官进行了独立的RNA速率分析。与综合轨迹分析类似,我们发现从hPSC胎儿肺集群0到集群1和2的轨迹(图8G),以及从hPSC类器官集群1和4到集群0和2的轨迹(图8H)。
总体而言,我们的hPSC分化胎儿细胞模型捕获了一些上皮细胞类型/状态和轨迹,特别是从芽尖到TP细胞,以及在原代胎儿假腺/小管肺组织中观察到的几种中间状态(图8I)。
总之,我们提供了人类胎儿肺的高分辨率时空图谱,重点关注上皮细胞和相互作用的基质细胞在形成发育中的气道中的谱系关系(图9)。
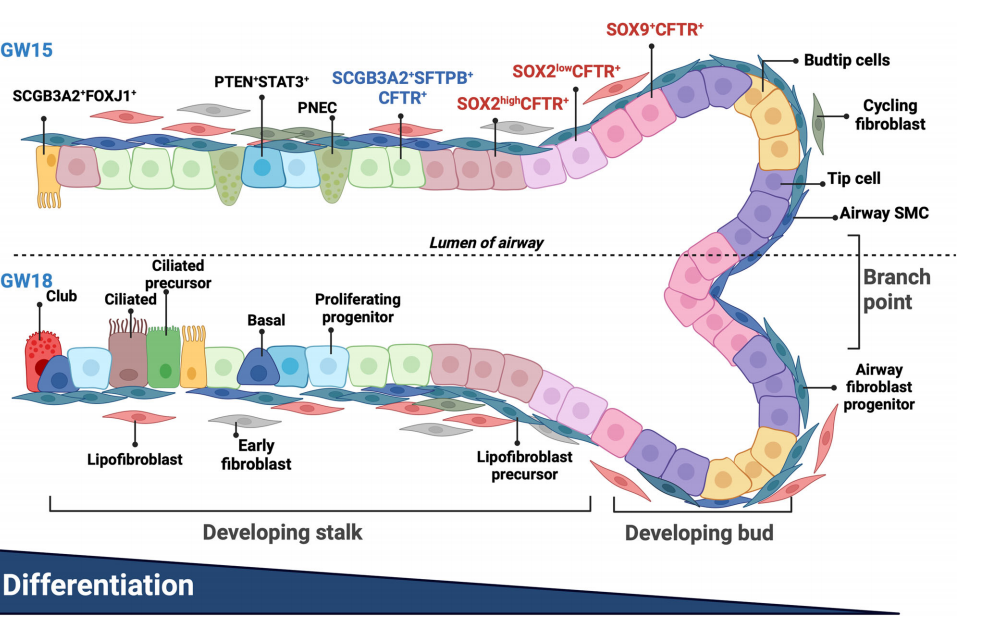
图9
导语
发育机制的再激活发生在疾病发病机制和组织修复期间。因此,了解正常发育下细胞的可塑性以及局部细胞信号环境在决定细胞命运和功能中的作用,可能为先天性肺病、慢性疾病发病机制和细胞对治疗的反应提供关键见解。在这里,我们构建了一个发育中的人类胎儿肺的综合转录组图谱,该图谱捕获了超过 150000个胎儿肺细胞,并确定了揭示上皮区室内显着细胞可塑性的发育轨迹。通过空间分辨转录组学,我们确定了可能决定发育中肺内细胞命运和行为的推定时间调节的细胞信号传导相互作用。最后,我们揭示了hPSC的分化沿着相似的发育轨迹进行,并产生与在人胎儿肺上皮中观察到的相似的胎儿细胞类型/状态。
影响细胞命运决定的发育过程是由细胞微环境中精确的细胞间信号传导相互作用介导的。虽然细胞可能共享转录组基因特征,但细胞自主或非细胞自主信号转导可能决定这些细胞如何发育。在这里,我们专注于上皮-上皮细胞和上皮-基质细胞之间的信号传导通讯。然而,它并不排除免疫、内皮和神经(雪旺)细胞的贡献,这些细胞也是共同发育并居住在前两种细胞类型附近。事实上,免疫细胞群对上皮发育的贡献最近已在胎肺中得到证实。相应地,我们在上皮细胞的轨迹分析中看到了白细胞介素通路的表达,这可能表明来自免疫细胞的信号传导。在我们的细胞通讯和轨迹分析中,我们显示了靶向 TP 细胞的FGF、WNT和 NOTCH信号通路的时间变化。信号转导的空间和时间调节都可以改变细胞错综复杂的微环境,并影响其行为和潜在的细胞命运变化。为了确认我们的结果,使用Xenium来优化上皮细胞和基质细胞类型的空间接近度,并通过TP分析了推定的信号转导。
我们研究的一个重要方面是 hPSC 衍生的胎肺分化的基准。在这里,我们表明 hPSC 衍生的胎儿肺细胞和类器官捕获了在天然组织中观察到的几种胎儿特异性细胞类型/状态和分化轨迹。具体来说,我们表明分化的 hPSC 衍生的胎儿肺细胞主要代表增殖细胞和祖细胞,而 hPSC 衍生的胎儿类器官包含代表肺发育后期的分化细胞。由于并非所有细胞类型和轨迹都在 hPSC 分化中被捕获,因此未来的研究可能会利用 LR 相互作用的预测和特定信号通路的富集来修改当前的分化方案并改善体外其他上皮细胞类型的产生。总体而言,我们的工作支持使用 hPSC 衍生的胎肺上皮模型作为研究胎肺上皮谱系发育的潜在替代模型。重要的是,hPSC 分化是实验上易于处理的模型,可用于研究更广泛的发育范围和疾病的胎儿起源,这使得这些模型的基准测试和验证尤为重要。
总之,我们的研究确定了有助于早期人类胎儿肺上皮动态发育的细胞类型、状态、轨迹以及局部细胞和信号相互作用。了解人类胎儿肺细胞多样性及其在发育中的作用将改进当前 hPSC 的分化方案,从而为未来先天性和慢性肺病的治疗生成更好的类器官模型或真正的细胞类型。
参考文献:
Quach H, Farrell S, Wu MJM, Kanagarajah K, Leung JW, Xu X, Kallurkar P, Turinsky AL, Bear CE, Ratjen F, Kalish B, Goyal S, Moraes TJ, Wong AP. Early human fetal lung atlas reveals the temporal dynamics of epithelial cell plasticity. Nat Commun. 2024 Jul 13;15(1):5898. doi: 10.1038/s41467-024-50281-5. PMID: 39003323; PMCID: PMC11246468.
